QR-Code - Kartenaufruf zum Klicken oder Scannen
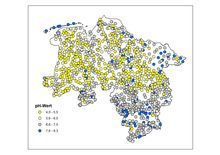
pH-Wert
Der pH-Wert ist ein Maß für den sauren oder alkalischen Charakter einer Lösung. Er beeinflusst viele chemische und biologische Prozesse. Die Trinkwasserverordnung sieht für den pH-Wert einen Bereich von 6,5 bis 9,5 vor, um eine korrosive Wirkung des Wassers auszuschließen.
Der pH-Wert ist eine Maßzahl für den sauren oder alkalischen Charakter einer wässrigen Lösung. pH-Werte unter 7 zeigen saure Verhältnisse an, pH-Werte über 7 zeigen basische Verhältnisse an. pH 7 entspricht einer neutralen Lösung. Der pH-Wert ist definiert als negativer dekadischer Logarithmus der Wasserstoffionenaktivität.
Der pH-Wert von unbelastetem Grundwasser liegt im Allgemeinen zwischen 6 und 8,5 (UBA, 2004). Unbelastete Niederschläge weisen einen pH-Wert von 5,6 auf. Sinkt der pH-Wert in natürlichen Ökosystemen unter diesen Wert, spricht man von Versauerung (UBA, 2004).
Verschiedene Salze reagieren mit Hydroxidionen und können so einen Eintrag von Säuren abpuffern und den pH-Wert stabil halten. Eine besondere Rolle spielt hierbei das Karbonat-Kohlensäure-Gleichgewicht. Dessen Pufferwirkung beruht auf dem Lösungsgleichgewicht von Kalziumkarbonat und bewirkt einen pH-Wert im neutralen Bereich. Ein Säureeintrag führt zur Auflösung der Karbonate, daher kann nur ein begrenzter Säureeintrag abgepuffert werden, bevor eine Versauerung eintritt. Der pH-Wert von Grundwässern aus gut gepufferten karbonathaltigen Aquiferen liegt daher höher als der pH-Wert von Grundwässern aus karbonatarmen Gesteinen, wie z.B. Sandsteinen, Quarziten oder Graniten. Gerade die Grundwässer aus karbonatarmen Gesteinen sind anfällig für eine Versauerung des Grundwassers (Kunkel et al., 2002).
Ein Eintrag von Säuren in den Boden und das Grundwasser erfolgt über den Eintrag von Stickoxiden und Schwefelverbindungen aus der Luft bzw. über den Niederschlag („saurer Regen“). Ein weiterer Versauerungsprozess im Grundwasser ist die Oxidation von Pyrit (FeS2). Unter sauerstofffreien Bedingungen kommen Pyrite in geringen Mengen in Sedimenten vor. Ein Absinken des Grundwasserspiegels führt infolge des Eindringens von Sauerstoff zu einer Oxidation der Pyrite und der Bildung von Schwefelsäure (z.B. im Braunkohletagebau) (UBA, 2004). Auch ein Nitrateintrag kann eine Pyritoxidation (sogenannte autotrophe Denitrifikation) mit entsprechenden Versauerungserscheinungen bewirken (Kölle, 2010).
In der öffentlichen Wasserversorgung wirkt sich der pH-Wert des Grundwassers auf den Geschmack, die Wirksamkeit von Chlorungsmaßnahmen, die Korrosion (von Baumaterial) und die industrielle Verwendbarkeit des Wassers aus (UBA, 2004). Der pH-Wert ist ein sehr wichtiger Einflussfaktor im Zusammenhang mit chemischer Verwitterung, mit Auswaschungsprozessen im Boden und in weiterer Folge mit dem Gehalt an Spurenelementen im Grundwasser. Er kann Grundwasser für Bewässerungszwecke unbrauchbar machen und die aquatische Flora und Fauna negativ beeinflussen. Bei einem pH-Wert unter 6,0 greift Grundwasser unter Umständen Beton an und begünstigt die Bildung von Kohlensäure aus Bikarbonaten (UBA, 2004).
Der pH-Wert ist ein sehr wichtiger Regulator von chemischen und biologischen Prozessen im Wasser. Stark saure und alkalische Verhältnisse wirken toxisch auf Organismen. Viele Schwermetalle bilden schwerlösliche Salze, deren Löslichkeit mit abnehmendem pH (zunehmend sauren Verhältnissen) zunimmt. Versauerung kann somit eine Mobilisierung von Schwermetallen wie Blei, Cadmium, Chrom, Eisen, Kupfer, Nickel, Quecksilber und Zink bewirken (Blefert, 1995, Alloway & Ayres 1996).